高校2年生 化学(ヘスの法則)
今さらですが、9月の中旬より「反応熱と熱化学方程式」について学習しました。
化学変化に伴って出入りする熱のことを「反応熱」といいます。
調理のとき、ガスを燃焼させ、その熱を利用してお湯を沸かすと思いますが、
この場合は燃焼によって発生する熱なので、特に「燃焼熱」といいます。
さて、今回の実験では、マグネシウムの燃焼熱の大きさQを求めることにしました。
Mg + 1/2 O2 = MgO + Q kJ
しかし、マグネシウムの燃焼熱については、直接その大きさを測定することができないため、
「ヘスの法則」を利用して間接的に求めることにします。

まず、マグネシウムと酸化マグネシウムの粉末をはかりとり、
それぞれを塩酸に溶かしたときの反応熱Q1、Q2を算出しました。
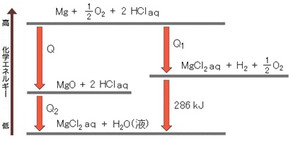
「ヘスの法則」とは、反応物と生成物が同じならば、反応の経路が異なっても
反応熱の大きさは変わらないというものです。
上の図を利用すると、燃焼熱Qを算出することができますね。
